Химия находит применение в различных отраслях деятельности человека – медицине, сельском хозяйстве, производстве керамических изделий, лаков, красок, автомобильной, текстильной, металлургической и других отраслях промышленности. В повседневной жизни человека химия нашла отражение прежде всего в различных предметах бытовой химии (моющие и дезинфицирующие средства, средства по уходу за мебелью, стеклянными и зеркальными поверхностями и т.д.), лекарственных препаратах, косметических средствах, различных изделиях из пластмасс, красках, клеях, средствах для борьбы с насекомыми, удобрениями и т.д. Этот список можно продолжать практически бесконечно, рассмотрим лишь некоторые его пункты.
Предметы бытовой химии
Из предметов бытовой химии первое место по масштабам производства и применения занимают моющие средства, среди которых наиболее популярны различные мыла, стиральные порошки и жидкие моющие средства (шампуни и гели).
Мыла представляют собой смеси солей (калиевые или натриевые) жирных ненасыщенных кислот (стеариновая, пальмитиновая и др.), причем натриевые соли образуют твердые мыла, а калиевые – жидкие.
Мыла получают по реакции гидролиза жиров в присутствии щелочей (омыление). Рассмотрим получение мыла на примере омыления тристеарина (триглицерид стеариновой кислоты):
где C 17 H 35 COONa и есть мыло – натриевая соль стеариновой кислоты (стеарат натрия).
Получение мыла возможно и с использованием в качестве сырья алкилсульфатов (соли сложных эфиров высших спиртов и серной кислоты):
R-CH 2 -OH + H 2 SO 4 = R-CH 2 -O-SO 2 –OH (сложный эфир серной кислоты) + H 2 O
R-CH 2 -O-SO 2 –OH + NaOH = R-CH 2 -O-SO 2 –ONa (мыло – алкилсульфат натрия) + H 2 O
В зависимости от сферы применения выделяют хозяйственные, косметические (жидкие и твердые) мыла, а также мыло ручной работы. В мыло дополнительно можно ввести различные ароматизаторы, красители или отдушки.
Синтетические моющие средства (стиральные порошки, гели, пасты, шампуни) представляют собой сложные по химическому составу смеси нескольких компонентов, главной составляющей частью которых являются поверхностно-активные вещества (ПАВ). Среди ПАВов выделяют ионогенные (анионные, катионные, амфотерные) и неионогенные ПАВ. Для производства синтетических моющих средств обычно применяют иногенные анионные ПАВы, представляющие собой алкилсульфаты, аминосульфаты, сульфосукцинаты и др. соединения, которые диссоциируют на ионы в водном растворе.
Порошкообразные моющие средства обычно содержат различные добавки для устранения жировых загрязнений. Чаще всего это кальцинированная или питьевая соду, фосфаты натрия.
К некоторым порошками добавляют химические отбеливатели — органические и неорганические соединения, при разложении которых происходит выделение активного кислорода или хлора. Иногда, в качестве отбеливающих добавок используют ферменты, которые за счет быстрого процесса расщепления белка хорошо удаляют загрязнения органического происхождения.
Изделия из полимеров
Полимеры- высокомолекулярные соединения, макромолекулы которых, состоят из «мономерных звеньев» — молекул неорганических или органических веществ, соединённых соединенных между собой химическими или координационными связями.
Изделия из полимеров нашли широкое применение в повседневной жизни человечества – это всевозможные бытовые принадлежности — кухонная утварь, предметы для ванной комнаты, приборы хозяйственного и бытового назначения, емкости, для хранения, упаковочные материалы и т.д. Волокна полимеров применяются для изготовления разнообразных тканей, трикотажа, чулочно-носочных изделий, искусственного меха гардин, ковров, обивочных материалов для мебели и автомашин. Из синтетического каучук производят резинотехнические изделия (сапоги, галоши, кеды, коврики, подошвы для обуви и т.д.).
Среди множества полимерных материалов широко используют полиэтилен, полипропилен, поливинлхлорид, тефлон, полиакрилат и пенопласт.
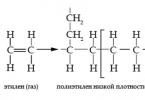
Среди изделий из полиэтилена наибольшую известность в быту получили полиэтиленовая плёнка, всевозможная тара (бутылки, банки, ящики, канистры и т.д.), трубы для канализации, дренажа, водо-, газоснабжения, броня, теплоизоляторы, термоклей и т.д. Всю эту продукцию производят из полиэтилена, получаемого двумя способами – при высоком (1) и низком давлении (2):


ОПРЕДЕЛЕНИЕ
Полипропилен – полимер, полученный полимеризацией пропилена в присутствии катализаторов (например, смесь TiCl 4 и AlR 3):
n CH 2 =CH(CH 3) → [-CH 2 -CH(CH 3)-] n
Широкое применение этот материал нашел в производстве упаковочных материалов, предметов домашнего обихода, нетканых материалов, одноразовых шприцов, в строительстве для вибро- и шумоизоляции межэтажных перекрытий в системах «плавающий пол».
Поливинилхлорид (ПВХ) – полимер, полученный суспензионной или эмульсионной полимеризацией винилхлорида, а также полимеризацией в массе:
Применяется для электроизоляции проводов и кабелей, производства листов, труб, пленок для натяжных потолков, искусственных кож, линолеума, профилей для изготовления окон и дверей.
Поливинилхлорид используют как уплотнитель в бытовых холодильниках, вместо относительно сложных механических затворов. Из ПВХ также делают презервативы для людей с аллергией на латекс.
Косметические средства
Основные продукты косметической химии – это всевозможные кремы, лосьоны, маски для лица, волос и тела, духи, туалетная вода, краски для волос, туши, лаки для волос и ногтей и т.д. В состав косметических средств входят вещества, которые содержатся в тканях, для которых предназначены эти средства. Так, в косметические препараты по уходу за ногтями, кожей и волосами входят аминокислоты, пептиды, жиры, масла, углеводы и витамины, т.е. вещества, необходимые для жизни клеток, составляющих эти ткани.
Помимо веществ, получаемых из природного сырья (например, всевозможные растительные экстракты) в производстве косметических средств широко используют синтетические виды сырья, которые получают путем химического (чаще органического) синтеза. Вещества, полученные таким путем, характеризуются высокой степенью чистоты.
Основные виды сырья для производства косметических средств естественные и синтетические животные (куриный, норковый, свиной) и растительные (хлопковое, льняное, касторовое масло) жиры, масла и воски, углеводороды, ПАВы, витамины и стабилизаторы.
РЕФЕРАТ
по курсу "Концепции современного естествознания"
по теме: "Химия в современном естествознании"
1. Химия в системе "общество - природа"
На протяжении длительного развития человечество не раз сталкивалось с большим числом проблем, от которых нередко зависело само его существование. Чтобы выжить, наш предок научился изготавливать и использовать простейшие орудия труда, чем компенсировал свои природные недостатки. В дальнейшем первобытный человек, оказавшись перед проблемой обеспечения пищей, освоил охоту, а затем земледелие и скотоводство. Освоение все более сложных орудий и предметов труда вызвало энергетическую проблему, потребовало перехода от естественных источников энергии к более совершенным. Энергетическая проблема последовательно привела человека к освоению энергии пара, тепловой, электрической энергии, наконец, энергии атома.
Необходимость повышения производительности труда и эффективности производства, роста темпов добычи и переработки громадного объема минеральных ресурсов, наряду с необходимостью решения многих жизненно важных проблем вызвали к жизни использование химической технологии, всеобщую химизацию, а затем и компьютеризацию общественного производства и быта.
Суммируя, можно сказать, что лейтмотивом, осью развития человеческой цивилизации была и есть проблема выживания человеческого общества в условиях окружающей среды, природы в целом. Мотив выживания, как представляется, есть ведущий мотив всей преобразующей деятельности человека на земле. Для своего выражения человек всегда будет вынужден решать вечные проблемы овладения веществом, энергией и информацией.
Успехи человека в решении больших и малых проблем выживания в значительной мере были достигнуты благодаря развитию химии, становлению различных химических технологий. Успехи многих отраслей человеческой деятельности, таких как энергетика, металлургия, машиностроение, легкая и пищевая промышленность и других, во многом зависят от состояния и развития химии. Огромное значение химия имеет для успешной работы сельскохозяйственного производства, фармацевтической промышленности, обеспечения быта человека.
Химическая промышленность производит десятки тысяч наименований продуктов, многие из которых по технологическим и экономическим характеристикам успешно конкурируют с традиционными материалами, а часть - являются уникальными по своим параметрам. Химия дает материалы с заранее заданными свойствами, в том числе и такими, которые не встречаются в природе. Подобные материалы позволяют проводить технологические процессы с большими скоростями, температурами, давлениями, в условиях агрессивных сред. Для промышленности химия поставляет такие продукты, как кислоты и щелочи, краски, синтетические волокна и т. п. Для сельского хозяйства химическая промышленность выпускает минеральные удобрения, средства защиты от вредителей, химические добавки и консерванты к кормам для животных. Для домашнего хозяйства и быта химия поставляет моющие средства, краски, аэрозоли и другие продукты.
Химия характерна не только тем, что обеспечивает производство многих необходимых продуктов, материалов, лекарств. Во многих отраслях промышленности и сельскохозяйственного производства широко используются также химические методы обработки: беление, крашение, печатание в текстильной промышленности; обезжиривание, травление, цианирование в машиностроении; кислородное дутье в металлургии; консервация, синтезирование витаминов и аминокислот - в пищевой и фармацевтической промышленности и т. д. Внедрение химических методов ведет к интенсификации технологических процессов, увеличению выхода полезного вещества, снижению отходов, повышению качества продукции.
Таким образом, химизация, как процесс внедрения химических методов в общественное производство и быт, позволила человеку решить многие технические, экономические и социальные проблемы. Однако масштабность, а нередко и неуправляемость этого процесса обернулась "второй стороной медали". Химия прямо или опосредованно затронула практически все компоненты окружающей среды - сушу, атмосферу, воду Мирового океана, внедрилась в природные круговороты веществ. В результате этого нарушилось сложившееся в течение миллионов лет равновесие природных процессов на планете, химизация стала заметно отражаться на здоровье самого человека. Получилась ситуация, которую ученые обоснованно именуют химической войной против населения Земли. За последние 30-40 лет в этой войне пострадали сотни миллионов жителей планеты. Возникла самостоятельная ветвь экологической науки - химическая экология.
Основными источниками, загрязняющими окружающую среду, кроме собственно химической промышленности, являются металлургия, автомобильный транспорт, тепловые электростанции. Они дают большой объем газообразных отходов, загрязняют водоемы рек и озер сточными водами, используемыми в технологических целях. Газообразные отходы содержат оксиды углерода, серы, азота, соединения свинца, ртути, бензопирен, сероводород и другие вредные вещества. В связи со сжиганием топлива в больших объемах возникла проблема снижения концентрации кислорода и озона в атмосфере, получившая название "кислородного голодания".
К твердым отходам относятся отходы горнодобывающей промышленности, строительный и бытовой мусор. Сточные воды содержат многие неорганические соединения - ионы ртути, цинка, кадмия, меди, никеля и т. д. Пятая часть вод Мирового океана загрязнена нефтью и нефтепродуктами. Значительный ущерб водоемам вследствие вымывания удобрений из почвы наносят загрязнения, связанные с сельскохозяйственным производством. Вредные вещества из воздуха и воды попадают в почву, в которой накапливаются тяжелые металлы, радиоактивные элементы.
В организм человека вредные вещества попадают через воздух, воду и пищу. Таким образом, человечество, пройдя ряд этапов развития - от огня костра до термоядерной бомбы, - в начале XXI века оказалось в условиях, когда в очередной раз встал вопрос о его выживании. Угроза экологической катастрофы требует решительного пересмотра отношений современной "химической" цивилизации и природы в сторону оптимизации этих отношений. Задача заключается в том, чтобы через новые технологии гармонизировать отношения "общество - природа" таким образом, чтобы компенсаторных возможностей окружающей среды было достаточно для нейтрализации антропогенных воздействий на нее.
Новые технологии по своим параметрам должны приближаться к природным процессам, отличаться от промышленных своей безотходностью или малоотходностью. В безотходном производстве технологический цикл "сырье - производство - использование готовое продукта - вторичное сырье" вписывается в окружающую среду, не нарушая экономического развития. В настоящее время наметились следующие пути решения сложных экологических проблем: комплексная переработка сырья; пересмотр традиционных процессов и схем получения известных продуктов; внедрение бессточных и замкнутых схем водопотребления; очистка выбрасываемых газов; использование промышленных комплексов с замкнутой структурой материальных и энергетических потоков.
Проблема выживания человека в конце XX века оказалась усложненной проблемами геополитического, социального и чисто технического характера. Решение последних затруднено ввиду потребительского характера сложившейся цивилизации и эгоцентризма индустриально развитых стран. Однако, опираясь на идеи В.И. Вернадского о перерастании биосферы в ноосферу, можно говорить о неслучайности появления человека на Земле, о его предназначении в кризисной ситуации сыграть роль спасителя природы.
Экологические проблемы порождены не только экономикой и техникой, но и нравственным состоянием человека. Вопрос состоит не только в том, чтобы остановить процесс разрушения природы техническими средствами. Вопрос состоит в том, чтобы в корне изменить потребительское отношение человека к окружающему миру. Человечество должно стремиться не просто к выживанию, но и к нормальной, достойной каждого человека жизни в условиях гармонии с природой.
Из сказанного вытекает, что место и роль химии в современной цивилизации должны рассматриваться системно, т. е. во всем многообразии отношений, существующих между обществом и природной средой в рамках критерия экологической безопасности. При этом неизбежно рассмотрение химии как активного элемента сложной системы "общество - природа", представляющего собой, в свою очередь, открытую систему со своей структурой и взаимообменом между веществом, энергией и информацией.
2. Предмет химии
Химия - это естественная наука, изучающая состав, свойства и химические превращения веществ, явления, которые сопровождают эти превращения, а также рассматривает вопросы использования результатов этих превращений. Самое краткое определение предмета химии дал великий русский ученый-химик Д.И. Менделеев в книге "Основы химии". По Менделееву, химия - это учение об элементах и их соединениях.
Отдельные химические процессы (получение материалов из руд, крашение тканей и др.) использовались еще на заре становления человеческой цивилизации. Позже, в Ш-IV веках, зародилась алхимия, задачей которой было превращение неблагородных металлов в благородные (золото, серебро). Начиная с эпохи Возрождения, химические исследования все в большей мере стали использовать для практических целей (металлургия, стеклоделие, керамика, получение красок и т. д.). Во второй половине XVII века Р. Бойль дал научное определение понятия "химический элемент".
Превращение химии в подлинную науку завершилось во второй половине XVIII века, когда был сформулирован закон сохранения массы вещества при химических реакциях (М.В. Ломоносов, А.Л. Лавуазье). В начале XIX века Дж. Дальтон ввел понятие "молекула". Атомно-молекулярные представления утвердились в 60-х годах XIX века. В этот период A.M. Бутлеров создал теорию строения химических соединений, а Д.И. Менделеев (1869 г.) открыл периодический закон (периодическая система элементов Менделеева). С конца XIX - начала XX века важнейшим направлением химии стала разработка теоретических основ науки (атомно-молекулярное учение), изучение закономерностей химических процессов.
Значение химии в жизни человека трудно переоценить. Приведём фундаментальные области, в которых химия оказывает своё созидательное воздействие на жизнь людей.
1. Возникновение и развитие жизни человека не возможно без химии. Именно химические процессы, многие тайны которых учёные ещё не раскрыли, ответственны за тот гигантский переход от неживой материи к простейшим одноклеточным, и далее к вершине современного эволюционного процесса - человеку.
2. Большинство материальных потребностей, возникающих в жизни человека, обслуживается природной химией или получает удовлетворение в результате использования в производстве химических процессов.
3. Даже возвышенные и гуманистические устремления людей в своей основе опираются на химию человеческого организма, и, в частности, сильно зависят от химических процессов в мозге человека.
Конечно же, всё богатство и разнообразие жизни нельзя свести только к химии. Но наряду с физикой и психологией, химия как наука, представляет собой определяющий фактор развития человеческой цивилизации.
Химия жизни
Насколько сейчас известно, наша планета образовалась приблизительно 4.6 миллиарда лет назад, а простейшие ферментирующие одноклеточные формы жизни существуют 3.5 миллиарда лет. Уже 3.1 миллиарда лет они могли бы использовать фотосинтез, но геологические данные об окислительном состоянии осадочных отложений железа указывают, что атмосфера Земли приобрела окислительный характер лишь 1.8-1.4 миллиарда лет назад. Многоклеточные формы жизни, которые, по-видимому, зависели от изобилия энергии, возможного только при дыхании кислородом, появились На Земле приблизительно от миллиарда до 700 миллионов лет назад, и именно в то время наметился путь дальнейшей эволюции высших организмов. Наиболее революционным шагом, после зарождения самой жизни, было использование внеземного источника энергии, Солнца. В конечном итоге, именно это превратило жалкие ростки жизни, которые использовали случайно встречающиеся природные молекулы с большой свободной энергией, в огромную силу, способную преобразовать поверхность планеты и даже выйти за её пределы.
В настоящее время учёные придерживаются точки зрения, что зарождение жизни на Земле происходило в восстановительной атмосфере, которая состояла из аммиака, метана, воды и диоксида углерода, но не содержала свободного кислорода.
Первые живые организмы получали энергию, разлагая молекулы небиологического происхождения с большой свободной энергией на меньшие молекулы без их окисления. Предполагается, что на ранней стадии существования Земли она имела восстановительную атмосферу, состоящую из таких газов как водород, метан, вода, аммиак и сероводород, но содержащую очень мало свободного кислорода или вообще его не имевшего. Свободный кислород разрушал бы органические соединения быстрее, чем они могли синтезироваться в результате естественно протекающих процессов (под воздействием электрического разряда, ультрафиолетового излучения, теплоты или естественной радиоактивности). В этих восстановительных условиях органические молекулы, которые образовались небиологическими способами, не могли разрушаться в результате окисления, как это происходит в наше время, а продолжали накапливаться в течении тысячелетий, до тех пор, пока, наконец, не появились компактные локализованные образования из химических веществ, которые можно уже считать живыми организмами.
Появившиеся живые организмы могли поддерживать существование за счёт разрушения естественно образующихся органических соединений, поглощая их энергию. Но если бы это был единственный источник энергии, то жизнь на нашей планете была бы крайне ограниченной. К счастью, около 3 миллиардов лет назад появились важные соединения металлов с порфиринами, и это открыло путь к использованию совершенно нового источника энергии – солнечного света. Первым шагом, который поднял жизнь на Земле над ролью простого потребителя органических соединений, было включение в неё процессов координационной химии.
По-видимому, перестройка явилась побочным следствием появления нового способа запасания энергии – фотосинтеза*, – который давал его обладателям огромное преимущество над простыми ферментативными поглотителями энергии. Организмы, в которых развилось это новое свойство, могли использовать энергию солнечного света для синтеза своих собственных энергоёмких молекул и уже не зависеть от того, что находится среди их окружения. Они стали предшественниками всех зелёных растений.
Сегодня все живые организмы можно подразделить на две категории: те, которые способны изготовлять свою собственную пищу при помощи солнечного света, и те, которые не имеют такой возможности. Скорее всего, и родственные ей бактерии сегодня являются живыми ископаемыми, потомками тех древних способных к ферментации анаэробов, которые отступили в редкие анаэробные области мира, когда атмосфера в целом накопила большие количества свободного кислорода и приобрела окислительный характер. Поскольку организмы второй категории существуют за счёт поедаемых ими организмов первой категории, накопление энергии посредством фотосинтеза является источником движущей силы для всего живущего на Земле.
Общая реакция фотосинтеза в зелёных растениях обратна реакции сгорания глюкозы и проходит с поглощением значительного количества энергии.
6 CO2 + 6 H2 O --> C6 H12 O6 + 6 O2
Вода расщепляется на элементы, что создаёт источник атомов водорода для восстановления углекислого газа в глюкозу, а нежелательный газообразный кислород выделяется в атмосферу. Энергия, необходимая для осуществления этого в высшей степени несамопроизвольного процесса, обеспечивается солнечным светом. В наиболее древних формах бактериального фотосинтеза в качестве источника восстановительного водорода использовалась не вода, а сероводород, органические вещества или сам газообразный водород, но лёгкая доступность воды сделала этот источник наиболее удобным, и в настоящее время он используется всеми водорослями и зелёными растениями. Простейшими организмами, в которых осуществляется фотосинтез с высвобождением кислорода, являются сине-зелёные водоросли. Их правильнее обозначать современным названием цианобактерии, поскольку это, в самом деле бактерии, научившиеся добывать собственную пищу из углекислого газа, воды и солнечного света.
К сожалению, фотосинтез приводит к высвобождению опасного побочного продукта, кислорода. Кислород был не только бесполезен для ранних организмов, он конкурировал с ними, окисляя естественно образующиеся органические соединения прежде, чем они могли быть окислены в процессе метаболизма этими организмами. Кислород представлял собой гораздо более эффективный «пожиратель» энергоёмких соединений, чем живая материя. Ещё хуже было то, что слой озона, который постепенно образовывался из кислорода в верхней части атмосферы, преграждал доступ ультрафиолетовому излучению Солнца и ещё более замедлял естественный синтез органических соединений. Со всех современных точек зрения, появление свободного кислорода в атмосфере представляло собой угрозу для жизни.
Но, как часто случается, жизнь сумела обойти это препятствие и даже обратила его в преимущество. Отходами жизнедеятельности первичных простейших организмов были такие соединения, как молочная кислота и этанол. Эти вещества намного менее энергоёмки по сравнению с сахарами, но они способны высвобождать большое количество энергии, если полностью окисляются до СО2 и Н2 О. В результате эволюции возникли живые организмы, способные «фиксировать» опасный кислород в виде Н2 О и СО2, а взамен получать энергию сгорания того, что прежде было их отходами. Преимущества сжигания пищи с помощью кислорода оказались столь велики, что подавляющее большинство форм жизни – растения и животные – пользуются в настоящее время кислородным дыханием.
Когда появились новые источники энергии, возникла новая проблема, связанная уже не с получением пищи или кислорода, а с транспортировкой кислорода в надлежащее место организма. Малые организмы могли обходиться простой диффузией газов через содержащиеся в них жидкости, но этого недостаточно для многоклеточных существ. Так перед эволюцией возникла очередная преграда.
Выход из тупика в третий раз оказался возможен благодаря процессам координационной химии. Появились такие молекулы, состоящие из железа, порфирина и белка, в которых железо могло связывать молекулу кислорода, не окисляясь при этом. Кислород просто переносится в различные участки организма, чтобы высвободиться при надлежащих условиях – кислотности и недостатке кислорода. Одна из таких молекул, гемоглобин, переносит О2 в крови, а другая, миоглобин, получает и запасает (хранит) кислород в мышечных тканях до тех пор, пока он не понадобится в химических процессах. В результате появления миоглобина и гемоглобина были сняты ограничения на размеры живых организмов. Это привело к появлению разнообразных многоклеточных, и, в конечном итоге, человека.
* Фотосинтез – это процесс преобразования энергии света в энергию химической связи получающихся веществ.
** Метаболизм – расщепление богатых энергией веществ и извлечение их энергии.
Химия как зеркало жизни человека.
Оглянитесь вокруг, и Вы увидите, что жизнь современного человека невозможна без химии. Мы используем химию при производстве пищевых продуктов. Мы передвигаемся на автомобилях, металл, резина и пластик которых сделаны с использованием химических процессов. Мы используем духи, туалетную воду, мыло и дезодоранты, производство которых немыслимо без химии. Есть даже мнение, что самое возвышенное чувство человека, любовь, это набор определённых химических реакций в организме.
Такой подход к рассмотрению роли химии в жизни человека, является, на мой взгляд, упрощённым, и я предлагаю Вам его углубить и расширить, перейдя в совершенно новую плоскость оценки химии и её влияния на человеческое общество.
Относительно недавно человек понял, что сознательное подражание природе в технике может дать великолепный результат. Скопировав крыло птицы, мы создали самолёт. Рассмотрев способ передвижения червя, получили гусеницы трактора. Внимательнее приглядевшись к движениям кожи дельфинов и акул, смогли значительно увеличить скорость торпеды, при её движении в воде. Таких примеров можно привести ещё много, а ещё больше их станет, если мы чаще будем применять этот подход.
А что же химия? Неужели она, являясь на самом деле более «тонкой» и глубокой наукой, по сравнению с механикой макрообъектов, не даст нам никаких намёков и подсказок, рассмотрев которые, человек сделал бы очередной шаг в своём развитии. Оказывается, такие подсказки есть, просто их никто ещё не пытался найти и использовать. И оказалось, что эти подсказки касаются более высокой области, чем даваемые механикой.
Мир людей богат и разнообразен, но всё же поведение каждого человека в отдельности, и устойчивых человеческих групп или общностей, можно свести к определённому набору качеств. И здесь мы можем провести аналогию между атомом и человеком. Действительно, хотя количество различных атомов и ограничено, они могут располагаться в молекулах совершенно различными способами и на самом деле взаимодействовать по-разному, в зависимости от того, с чем приходится вступать в реакцию. Таков и человек.
Теперь дадим сравнение свойств атома (с точки зрения химии) и человека (с точки зрения человеческих взаимоотношений).
Самыми активными являются атомы щелочных металлов. Их отталкивающая защита из электронов мала и слаба, но зато они могут взаимодействовать практически со всеми химическими элементами. Человек такого типа, тоже может прекрасно общаться и уживаться с другими людьми. Но он потеряет при этом свою индивидуальность. Ведь и щелочные металлы не встречаются в чистом виде в природе, а находятся только в виде соединений.
С другой стороны инертные газа создают вокруг себя непреодолимый барьер из восьми электронов, и надо создать особые условия, чтобы заставить их вступить в реакцию. Так и люди. Отгораживаясь от всего мира, человек или общество, теряет способность к изменениям и к развитию, потому что взаимодействие – это взаимное действие. В его процессе изменяются обе стороны.
И наконец, идеал мира химических элементов – углерод. В этом элементе гармонично сочетаются защищённость (4 электрона) и открытость (4 вакансии). Причём распределение электронов может достаточно легко изменяться, не требуя больших энергетических затрат. Углерод способен образовать двойные и тройные связи, взаимодействуя с себе подобными.
В поисках идеала человека мы должны использовать эту информацию. Проявляя в своём поведении разумный компромисс между отстаиванием своих интересов (защита) и учётом мнения оппонента, изменяя слегка свои подходы к решению проблем, как атом углерода в процессе реакций изменяет расположение своих электронов и вакансий, мы продвинемся в деле получения результатов значительно дальше, чем, если бы сохраняли свою позицию неизменной.
С учётом того, что такой подход может быть применён большим количеством людей, то они, как одинаковые атомы углерода, смогут образовать прочные (двойные и тройные) связи. Тоже самое можно сказать и в отношении человеческих общностей (небольших групп, общественных объединений и целых государств).
Развивая эту мысль можно предположить, что наиболее перспективным путём развития человечества является направление, при котором в обществе будет существовать большое разнообразие взглядов и мнений, будет разрешено законом значительное количество способов действия, но большинство людей будет обладать универсальностью, способностью понимать других людей и взаимодействовать с ними, схожей с универсальность атома углерода. При таких условиях жизнь общества будет гармоничной и стабильной.
Пример водорода, в этом вопросе также очень показателен. Сократите сферу своего влияния (или уменьшите область своих запросов) и Вы, подобно атому водорода, сможете взаимодействовать и объединяться со значительно большим числом людей (элементов).
Итак, резюмируя всё выше сказанное, отметим, что химия в жизни человека может стать путеводной звездой для гармоничного развития всего человеческого общества.
Прикладные вопросы влияния химии на развитие жизни человека.
В предыдущей главе мы осветили философский подход к оценке химии в жизни человека. Это был, так сказать общий взгляд. Здесь же мы рассмотрим роль химии и её влияние на жизнь человека с позиций стратегии.
Если принять за главную цель существования человеческой цивилизации её гармоничное и всестороннее развитие, особенно в интеллектуальных вопросах, то встаёт вопрос, что на этом пути может сделать химия. Изучая поведение людей и особенно влияние на их поведение того, чем они питаются, можно сделать однозначное заключение. В натуральной здоровой пище содержатся вещества, которые могут не только повысить физическую отдачу организма, но и стимулировать его мозговую деятельность. Поэтому, применяя такую пищу в нужное время в нужных количествах, мы могли бы ускорить развитие человеческой цивилизации, не затрачивая на это больше ресурсов, чем сейчас. Такой подход является новой социальной инновацией, а, следовательно, роль химии в жизни человека возрастёт еще больше.
Необходимо провести крупномасштабные научные исследования в этой области и применить их результаты в повседневной жизни. Ведь даже такое социальное зло, как алкоголизм можно победить, грамотно используя «пищевой вопрос» в отношении страдающих этим недугом людей.
Скажу даже больше. Применение такого подхода в вопросах питания, находящихся в заключении людей, однозначно способно снизить уровень рецидива преступлений.
Этот же метод можно применить и к планированию рождаемости.
Конечно, в каждой из предложенных областей, мы не должны посягать на свободу выбора человека. Но учитывая, что - мы то, что мы едим – применение вышеупомянутых стратегий является вполне обоснованной альтернативой современным способам.
А теперь о самой, на мой взгляд, решающей старатегии, которую необходимо внедрить. Эта страница является частью сайта посвящённого общей теории взаимодействий, новой альтернативной теории. Химические процессы, да и само строение атомов, в этой теории показаны простым человеческим языком и с применением анимации, сравните это взгляды с теми, которые Вы встречали в учебниках. И сделайте совй выбор. Возможно, он будет не в пользу общей теории взаимодействий, но одно можно сказать точно. Химия предстанет перед Вами как интересная, без разрывов и несоответствий во взглядах, без необоснованных постулатов, наука, в которой нет границ для творчества. Вы можете используя общую теорию взаимодействий понять многие, очень туманно объяснённые вопросы. Причём описания, сделанные мною Вам даже не придётся запоминать, они сами зафиксируются в вашей памяти, потому что просты и непротиворечивы. Правда сдавать на экзамене Вам придётся нечто другое.
Химия в быту1. В какой капусте много йода?
2. Общее название мела, мрамора, известняка.
3. Для приготовления пышных оладьев понадобится: кефир; мука; сахар; яйцо; сода; соль. Какой из перечисленных компонентов имеет ещё одно название - гидрокарбонат натрия?
4. Этот металл используют для приготовления консервных банок:

5. Закончите пословицу:
Сказанное слово – золото, не сказанное – ……….
6. В Древнем Китае размоченную кору тутового дерева расщепляли на тонкие ленты и варили в растворе извести два часа. Затем полученную массу разбивали молотком, добавляли в неё клей, заливали водой и все это просеивали через тонкое сито. Массу, осевшую в сите, опрокидывали на доску и прессовали. Полученное изделие просушивали и использовали. Для чего его использовали?
7. Какой металл был деньгами и остался ими до сих пор?
8.
 Накипь образуется на тех поверхностях теплообменных аппаратов, на которых происходит нагревание (кипение, испарение) воды с растворенными солями жесткости. Сколько чайников ей испорчено! Но, оказывается, накипь можно удалить с помощью 2-гидроксипропан-1,2,3-трикарбоновой кислоты, которая есть у каждого дома, только называем мы эту кислоту иначе - ……… .
Накипь образуется на тех поверхностях теплообменных аппаратов, на которых происходит нагревание (кипение, испарение) воды с растворенными солями жесткости. Сколько чайников ей испорчено! Но, оказывается, накипь можно удалить с помощью 2-гидроксипропан-1,2,3-трикарбоновой кислоты, которая есть у каждого дома, только называем мы эту кислоту иначе - ……… .
9. Нитрат этого металла принимает участие во всех салютах, внося ярко-зеленый цвет. Назовите металл, входящий в состав нитрата.
10. Таджикская пословица гласит:
Регулярные занятия предохраняют ум от …………… и придают ему блеск.
11. Хлопчатобумажные ткани характеризуются хорошей износоустойчивостью, значительной прочностью, достаточной устойчивостью к многократным растяжениям и изгибам, хорошей гигроскопичностью, красивым внешним видом. Только часто под видом хлопчатобумажной ткани продают изделия из синтетики. Хлопок можно легко узнать: при сжигании хлопчатобумажной нити вы почувствуете запах ………… .
12.
 Водные растворы этого вещества широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
Водные растворы этого вещества широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
13. В Японии ею посыпают помост для борьбы сумо, чтобы отогнать злых духов.
Бруски её, называвшиеся амоле, служили в Эфиопии денежным средством до конца XIX века, наряду с металлическими монетами.
До появления консервов, пастеризации и холодильников она давала возможность сохранять продукты. Поэтому она стала символом долговечности.
О чем речь?
14. «Пища» для автомобиля.
15. Он в белом песке и кварце,
В составе стекла и в сплавах.
А если в резину войдет,
Стойкость к жаре и морозу ей придает. О чем речь?
16. По приказу Наполеона для солдат было разработано дезинфицирующее средство с тройным эффектом – лечебным, гигиеническим и освежающим. Ничего лучше не было придумано и через 100 лет, поэтому в 1913 году на выставке в Париже это вещество получило Гран – при. Под каким названием оно выпускается у нас в стране?

17. Какой химический элемент составляет основу

орудия художника?
18. Знаете ли вы, что теннисные мячи не надувают, а вводят в них специальные вещества – «вздуватели»? «Вздуватели – это вещества, которые при нагревании разлагаются с образованием газообразного вещества. В теннисные мячи кладут таблетки нитрита натрия и хлорида аммония и нагревают. Происходит химическая реакция, в результате которой и выделяется газ.

Какой газ создает в теннисном мяче повышенное давление?
19. Разбавленные растворы (около 0,1 %) этого вещества нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов, промываний желудка при отравлениях – именно поэтому содержится почти во всех домашних аптечках. Водный раствор вещества используется для травления дерева, в качестве морилки. О каком веществе идет речь?
20. Стебель и листья крапивы покрыты тонкими ворсинками.
Когда человек касается листа, волосок прокалывает кожу, верхняя часть волоска отламывается, и в ранку попадает содержимое стрекательной клетки. Оно содержит кислоту и раздражает нашу кожу, когда вытекает. Какая кислота так больно жалит?

Государственное образовательное учреждение
Среднего профессионального образования
Киселевский педагогический колледж
Химия в стихах
(сборник стихов по химии для обучающихся и преподавателей химии, авт.- сост. Т. А. Манышева)
Сборник включает стихи по основным темам общей, неорганической и органической химии, изучаемым в общеобразовательных и других учебных заведениях. Это пособие может быть рекомендовано тем, кто изучает и любит химию и преподавателям химии.
Насильное обучение не может быть твёрдым,
Но то, что с радостью и весельем входит,
Крепко западает в души внимающим.
Василий Великий
В настоящее время идёт становление новой системы образования, ориентированного на вхождение в мировое образовательное пространство. Общие тенденции развития образования - это не только значительное расширение сферы компетенций обучающихся, но и повышение их культуры, максимальное развитие способностей, творческого потенциала и индивидуальности, формирование у них гуманистической системы ценностей, а также сохранение и укрепление здоровья.
В последние годы большинство обучающихся все чаще относят химию к числу нелюбимых и трудных предметов, так как, прежде всего не могут усвоить тот минимум сведений, без которых невозможно понять предмет. Желание каждого преподавателя - привить любовь и интерес к предмету, добиться максимально высокого уровня понимания и знаний, заботиться о здоровье обучающихся и о собственном здоровье, выстраивая бесконфликтные, доброжелательные отношения. Этому способ способствует создание лирического эмоционального настроя с помощью художественного слова.
Выразительность и яркость художественного слова позволяет разнообразить и оживить изложение сухого химического материала, вызвать интерес к теме и предмету в целом, активизировать ассоциативную память, способствует эстетическому воспитанию, а также снимает напряжение и усталость. Удачно подобранная рифма или сравнение помогают легче понять и запомнить состав вещества, то или иное свойство изучаемых элементов, соединений и происходящих с ними явлений.
Произведения художественной литературы, совершенствуя образное мышление обучающихся, могут оказать благотворное влияние на развитие их воображения, способность высказывать оригинальные идеи, то есть тех качеств, которые необходимы для научного творчества. В этой связи уместно привести слова известного советского химика А.Е. Арбузова: "Не могу представить себе химика, не знакомого с высотами поэзии, с картинами живописи, с хорошей музыкой. Вряд ли он создаст что-либо значительное в своей области..."
Современный преподаватель должен быть разносторонним человеком. Ему не чужда лирика. Чувствуя увлеченность преподавателя, и обучающиеся увлекаются, приобщаются к художественному творчеству: начинают писать стихи, рассказы, сказки, сочинять загадки. И постепенно из не любимого и трудного химия переходит в ранг интересных, занимательных и доступных пониманию предметов.
Методика использования художественных произведений может быть разнообразной. Если отрывок содержит описание химического явления, то его целесообразно зачитать для иллюстрации изучаемого материала. Можно поступить и иначе: зачитав фрагмент из художественного произведения, спросить обучающихся: о каком химическом явлении идет речь в цитируемом тексте? Какая химическая реакция соответствует данному описанию? Как составить уравнение реакции? Сопровождение демонстрационного эксперимента стихами позволяет легче понять и запомнить условия и признаки реакций, характерные свойства веществ.
В настоящий сборник включены стихи выдающихся учёных-химиков: М. В. Ломоносова и Н. А. Морозова, известных поэтов: С. Щипачёва, Л. Мартынова, В. Шаламова, Е. Ефимовского и др., обучающихся и преподавателей различных учебных заведений, студентов Киселёвского педагогического колледжа. Стихи неизвестных составителю авторов отмечены * .
Сборник состоит из трёх разделов. Раздел I посвящён науке химии. Его открывает стихотворение студентки Киселёвского педагогического колледжа А. Черновой "Наука "Химия". Во II разделе раскрываются основные химические понятия, такие как электроотрицательность, степень окисления, аллотропия, электролиты, скорость химических реакций и др.
Раздел III - о химических элементах и веществах - посвящён периодической системе химических элементов Д. И. Менделеева, неметаллам, металлам (в порядке возрастания номера групп элементов) и их соединениям, а так же и органической химии. Некоторые стихи сопровождаются соответствующими формулами и уравнениями для лучшего понимания и запоминания.
Сборник может быть использован обучающимися общеобразовательных и других учреждений, а также учителями, как на уроках, так и во внеклассной работе для формирования и развития интереса к химии.
Наука "Химия"
Наука есть химия - волшебный предмет,
На любой из вопросов даст вам ответ.
Расскажет, откуда взялось вещество,
Состоит из чего, и получится что.
Узнаете вы достиженья ученых
И значение в чём их.
А уравненья и опыты сделайте вместе,
Ведь это серьёзно и так интересно!
Наука "Химия" всегда быть должна,
Она загадочна, но очень важна!
Услышится вам звук "химических лир",
И откроется в химию удивительный мир!
А. Чернова
Гидролиз
Соединениям некоторым характерно
Ну, например, солям,
Такое свойство: реагировать с водой,
Порой без внешних признаков,
Но непременно в ней разлагаться -
Здесь секрет простой.
Пословица в народе век бытует:
"Где тонко, там и рвётся",
Так и здесь: гидролиз там идёт,
Где компонент лишь слабый существует,
Ему с водой взаимодействовать -
Большая честь!
Компанию из букв " К " запомни:
Коль слабый к атион -
Идет гидролиз по нему,
И к атионы водорода образуясь,
Дают в растворе к ислую среду.
А если слабый анион появится в растворе,
Водой он вмиг же будет атакован,
И в результате их труда
От гидроксид-ионов
Щелочная явится среда.
Т. А. Манышева
***
Восстановитель – это тот, кто электроны отдаёт.
Сам отдаёт грабителю, злодею – окислителю!
Е.С. Ножко
Щелочные металлы
Вот металлы щелочные, Li, Na, K, Rb, Cs, Fr
Почему их так зовут? 2Ме + 2Н 2 О = 2МеОН + Н 2
Потому, что и они, и их оксиды Ме 2 О + Н 2 О = 2МеОН
Щёлочи в реакциях с водой дают. щёлочь
Нет на свете их активней
Средь металлов остальных.
В чем причина?
Электрон на внешнем слое
Лишь один у них. ns 1
C легкостью его теряя,
Окисляются везде:
В воздухе и чистом кислороде, Ме 0 - е - = Ме +1 окисление
И в азоте, в водороде, восстановитель
В галогенах и кислотах,
И в простой воде.
С возрастанием номера Ме Z Me R a
Растет активность их, Li св-ва
А степень окисления Na
Во всех соединениях K
Лишь плюс один у них. Rb
Лёгкие, пластичные, Fr
Режутся легко.
Страшно энергичные,
Брать нельзя рукой!
Их немного усмиряют,
В керосин всех погружая,
А легчайший литий
В вазелине скрытен.
Т. А. Манышева
Изомерия
Явление изомерии изучая,
Я вам, друзья, хочу сказать,
Для органических веществ
Оно так актуально,
Что надо нам его понять!
Насколько же природа многолика,
Что в формуле одной она дала
Нам множество веществ различных,
Своей структурой необычных,
А потому и свойствами отличных,
За это ей и похвала!
А вся причина - в углероде,
Что может цепи он давать
Неразветвленные и разветвленные,
Предельные и непредельные,
Открытые иль в циклы их
Способен замыкать.
Валентности своей при том не нарушая,
И оставаясь верным четырём,
Он создаёт нам мир
Живой, многообразный -
Согласно Бутлерову все мы в нём живём.
И нет предела в этом мире
И для природы, и профессоров.
Творят они в своих лабораториях
Бессчётное количество веществ,
Что органическими мы зовём.
Т. А. Манышева
Кузбасс - судьба моя
Кузбасс - шахтёрский край!
Край химиков и металлургов,
Могуч, суров, красив собой!
Тебя дано мне было выбрать,
Чтоб жизнь свою навек связать с тобой.
Окончив институт, по доброй воле
Приехала сюда из Подмосковья я.
Здесь начинала трудовой свой путь я в школе,
Здесь создалась семья моя.
Сменив чудесную природу
На непривычный взору моему пейзаж,
По уголку родному тосковала
И плакала, порой, не раз.
Порой, от стужи лютой замерзая
Иль утомившись от безудержной жары,
Умом и сердцем понимала,
Что значит слово гордое "сибиряки!"
Здоровье богатырское заключено в нём,
Сплав воли, мужества и доброты,
Металла стойкость,
Сердца жар, что, словно уголь раскалённый,
Гостеприимство русское и широта души.
"Некоренная я, но сибирячка!" -
Могу теперь сказать так про себя.
Земля Кузнецкая родной мне стала,
Ею горжусь, душой любя!
Горжусь масштабами её заводов,
Несметными запасами угля
И химией большой, к которой
Пусть немного, но всё-таки причастна я!
Т. А. Манышева
Предисловие.......................................................................................6
Раздел I. О науке химии....................................................................9
Наука "Химия"...................................................................................9
Гимн химии........................................................................................9
Гимн химиков..................................................................................10
Любовь химика................................................................................11
Раздел II. Основные понятия химии..............................................13
Электроотрицательность.................................................................13
Степень окисления...........................................................................14
Аллотропия.......................................................................................14
Электролиты.....................................................................................16
Правила протекания реакций ионного обмена.............................18
Электрон...........................................................................................18
Принцип Ле-Шателье......................................................................20
Скорость химических реакций.......................................................21
Гидролиз...........................................................................................22
Окраска индикаторов в различных средах....................................24
Раздел III. О химических элементах и веществах........................26
Читая Менделеева............................................................................26
Периодический закон......................................................................26
Периодическая система химических элементов...........................33
Химические элементы на защите Родины.....................................33
Известно: химия наука о веществах...............................................34
Храм природы..................................................................................36
Неметаллы........................................................................................36
Простые вещества - неметаллы......................................................36
Водород.............................................................................................37
Хоровые загадки..............................................................................38
Просто вода......................................................................................39
Дистиллированная вода..................................................................40
Свойства воды..................................................................................41
Свойства кислот...............................................................................47
Бор.....................................................................................................48
Парад элементов. IV группа...........................................................48
Углерод.............................................................................................49
Горючий уголь.................................................................................51
Оксиды углерода..............................................................................51
Поэма о минералах (отрывок)........................................................53
Братья карбонаты.............................................................................53
Кремний............................................................................................54
Элементы IVА группы....................................................................54
Письмо о пользе Стекла..................................................................56
Стекло и цемент...............................................................................62
Парад элементов. V группа.............................................................62
Азот...................................................................................................63
Басня "Спор".....................................................................................65
Аммиак..............................................................................................66
Фосфор..............................................................................................67
Мышьяк.............................................................................................69
Парад элементов. VI группа...........................................................69
Кислород...........................................................................................69
Открытие кислорода........................................................................73
Если исчезнет кислород..................................................................74
Кислород и водород.........................................................................75
Оксиды..............................................................................................75
Сера...................................................................................................78
Парад элементов. VII группа..........................................................80
Семейство солеродов.......................................................................80
Галогены...........................................................................................81
Фтор...................................................................................................83
Хлор...................................................................................................84
Йод.....................................................................................................85
Парад элементов. VIII группа. Инертные газы.............................85
Металлы............................................................................................87
Семь металлов создал свет... ..........................................................87
Металл - это точность... ..................................................................87
Электрохимический ряд напряжений металлов...........................88
Щелочные металлы.........................................................................90
Парад элементов. I группа..............................................................91
Литий.................................................................................................92
Натрий...............................................................................................92
Медь..................................................................................................94
Золото................................................................................................97
Парад элементов. II группа.............................................................97
Бериллий...........................................................................................98
Магний..............................................................................................98
Парад элементов. III группа............................................................99
Алюминий......................................................................................100
Олово...............................................................................................100
Парад элементов. VIIIгруппа........................................................101
Железо.............................................................................................102
Красная кровяная соль..................................................................106
Основания.......................................................................................107
Получение и свойства амфотерных гидроксидов.......................108
Гидроксиды....................................................................................110
Органическая химия......................................................................111
Считалочка.....................................................................................111
Классы органических соединений...............................................112
Изомерия.........................................................................................113
Радикалы... Радикалы....................................................................115
Каучу - "слёзы дерева"..................................................................116
Макинтош.......................................................................................117
Этанол - алкоголь...........................................................................119
Кислоты..........................................................................................120
Муравьиная кислота......................................................................123
Портрет уксусной кислоты...........................................................125
Гимн сложным эфирам..................................................................126
О нитроглицерине..........................................................................126
Ода пластмассам............................................................................127
Двадцатый век стал веком полимеров... .....................................128
Кузбасс - судьба моя......................................................................128
Я долг гражданский свой..............................................................130
Список литературы........................................................................131